�@
1���l�洫��B
�@�B���l�洫
(A)
�褸 1850 �~�^�������@��A�~�M�a Harry Stephen Messy Thompson
�Τ@��ƾǮaJohn Thomas
�V�Ӯa�A�~�Ƿ|���i���A�L���[��o�����Ļ� [(NH4)2SO4]
�g�L�g�h�ɡA�b�y�X���G�餤�o�{�t�����Ķt�C
(B)
�褸 1905 �~�w��դh R. Gans
�����H�ѵM�m�۰��h�������w�צ����@���ӷ~���欰�C
(C)
�褸 1913 �~����ì��� Permutit
���q�A���ץH�X���m�ۥX��A���ئX���m�۪��h�w�ׯ�O���۵M�m�۬��ΡC
�ѩ�o�ǰ�a�b���l�洫�u�~�o�i���}�l�A�y������Ƥd�U���������B�z�Ψ�L�γ~�����l�洫�l�ͪ������͡C
�G�B���l�P���l�洫
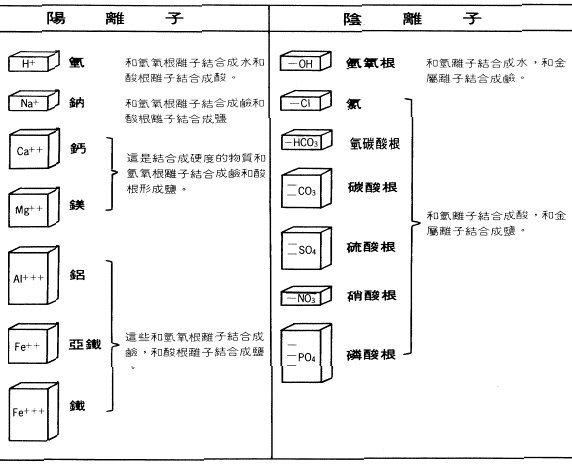
�N�ƦX�������p���ɡA���ܨϨ䤣����Ӥƾǩʽ誺�̤p���٬����l�A���y�ܻ��A���l����l�έ�l�ΩҺc�����A�����p�o�ǭ�l�έ�l�αa���q�ʡA�h�^�H�٤������l�C
�����l�ҭt�q���i�����ά��t�A���ݻP�B�����l���q�ʬ����A�s�������l�A�o�Ƕ����l�i�H�αa���t�q���������l���M���A�Ѧp�����l
(Cl-)�B���Į����l (SO4)
�����O�L�̪��Ҥl�C
�B���l (H+)
�P�����l�ƦX����(�p��ӲB���l�P�@�Ӳ��ĻĮ����l�ƦX��������
(H2SO4)�A�Ӫ��ݶ����l�P�����l�ƦX���Q�A�����ﰲ�p�ҤƦX�����������l���B������l
(OH-)�A�h�٬��P�C
�ĻP�P���@�ΡA�]�N�O���Ĥ����B���l�P�P�����B������l�ƦX����HOH
(H2O)
�Y���A�]�����P�Q���i�ɹq�A�G�^�H�٥����q�ѽ�C
���Ǥ��i��������O�ѳ\�h���l�Ʀ��[�����c��A�A�H�ۤϹq�ʪ����l�A�[�H�q�O�����X�A������l�]�i�Ψ�L�q�ʬۦP�����l�N�����C
���o�@�ت������ʪ���٤������l�洫���A�i�H�Φ۵M�ΤH�u����k�Ͳ����C
��i�@�B�A����ұa�q�������t�A�ڭ̥i�٥��̬����γ����l�洫���C
�T�B�����ҧt�������l
�B�Ѷ��h�U���A�g�L�j��ɡA�i���ѷL�q���ĩʮ���
(�p�G��ƺ�CO2�A�P�G��Ʋ� SO2)�A������F�a���H�ắ�J�g�h�A���Ѥg�[���Y�Ǫ���Х]�A���i�������Ѫ��A�Φ]���ɪ��B���㦳�ĩʦӦ����i�����C
�a�U�� (�p�����B�u��) �H�Ωҿצa���W���� (�e���B����B����) �h�h�֤֧��t���ǥi���ʪ���A�@�먥���A�o�ǥi���ʪ����賣�O�q�ѽ�A�]�N�O�t���l������C

�b�����s����L�����l�A�]�A�u���l
(Na+)�B�[���l (K+) �H�Τֶq�����K���l
(Fe2+)�B�����l (Mn2+) ��L�������l�C
�����ҧt���������l�����P�ʪ��A�һIJB���l (HCO3-)�B�һĮ����l (CO3) (�����l�������B������l (OH-))�A�H�δ����l (Cl-)�B���Į����l (SO42-)�B�v�Į����l(NO3-)�A���ɤ]���t���l (F-) �C�Į����l(PO43-) ���C
���������l
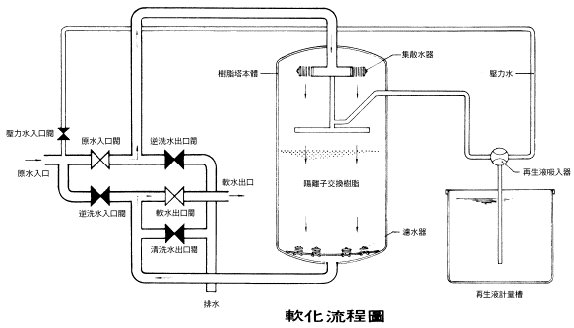
�|�B�����n��
(�w�ת����h)
�w���p�e�z�A�i�����l�μ��洫���ͫ��A���b�Ψm�Ƭ��w�z���e�A�Y�P�Ψm�ƦX�����Ū����A�]���˦äF�p�ФίD�Ǫ��˸m�A�Ϭ~�n����A���M����O�Ψm�����I�C
�������h�w�תk�A�O�N���N�m�A���h�һIJB�t
[Ca(HCO3)2] �P�һIJB��[Mg(HCO3)2]�B�ӷ~�W�Q�γo�Ӥ�k�h�w���s��
Clark's
�k�A�Υs���ۦdzn�ƪk�N�O�b���ѥ��k�]�O�@�˦a�Q�εۡA���O�����ణ�h��������ƶt(CaCl2)�B�����
(MgCl2) ���w��C
�褸 1905 �~ Dr. Gans
�Q�����l�洫�ӨϤ��n�ơC�O���l�洫�������ӷ~�欰�C�ۦ��H��Q�����l�洫�n�Ʀ����B�z�������M��k�A�L�F�Ʀ~��ΤѵM�P�H�u�s�y���m�ۡA����N���F��h�����l�洫���F�A�ߪ�j�����ѭf�A�m�P�G�A�m�f
(DVB)
�X�����洫��o�ت���㦳�������洫��O�Ϊ��z�Τƾǭ@�ʡC
���l�洫�Ϥ��n�ƬO�ά۵��q���u���l (Na-) ���N�������t���l�������l�A��]�O�u�Q�����ѫF 280000ppm�A�������H���A�]���|�M�Ψm�ƦX�����A�u�|���ͪw�z�A�ƾǤW�����n�ơA��L�{�p�U�G
�ѤW���i�H���աA�T�w�q�����l�洫��סA�u�t���T�w�ƥإi�洫���u���l���@�T�w�ƥإs����ץ洫��O�A�����@��O�����Χ��ɡA�]�N�O���Ҧ��u���l�����t�P�����l�Ҩ��N���ɡA�N�ݭn�ΦA�ͪk�A��u��_����Ӫ������A�٭쪺��k�i�ΥH�U���覡���ܤ��G
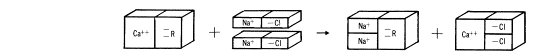
�n����ƧQ�Υi�洫���u���l�A�Y�R���Q�Υ����`�洫��O�A�u���b�٭�ɤj�q�[�J�L�q�����Q�~����A���@�뻡�ӡA���F�X�G�g�١A���Q�ä��ݦp���j�q�[�J�A�]���N���F�ާ@�ɥ洫��O�@���A�]���b�٭�ɡA�����IJv�O�ܭ��n���A�]�N�O�C��쭫�q���Q���h�w�ת��h�֬O�ܭ��n���A�ר�b�u�~�W�B�z���ɸ��a�x�B�z���ɧ��n�A�]���u�~�W�ݭn�j�q�����P�j�q���Q�A�����ŦX�g�٩ʡC
�b�u�{�W�������l�洫��O���M���N�y���C���ɾ�שүణ�h�w�誺���J��
(g/L) �Ϊ̥ΤƾǤW�����k�A�C�ɾ�װ��h�w��
milliequiualet (�@�J�q)�C
���B�����¤�
(���q)
�H���h�����������q����Ⱦa�]�H�k�A�]���L�k�j�q�s�y�A�u��ѵ���s�ĥΤ��B�W�q���Τ��B���İt�m�Τ��B���R�Τ����C�۱q���l�洫��תk�o���H��A�¤��s�y�N����t���o�i�A������Ϥ��«W���A�B�i�j�q�Ͳ��C�]����ݰ��«ץΤ����u�~�^�m���j�A�\�h�u�~���D�o�찪�~�誺���~�A��Τ���������Y��A�H���]�غح�]�L�k�j�q�Ͳ��A�P�ϳo�Ǥu�~�L�k���O�o�i�A�{���ĥζ����l�洫��P�����l�洫��ײզX�A�H�Ƨɦ��βV�ɦ��ϥΡA�i�o�찪�«ת����A�B�i�j�q�Ͳ��A�E�ϳo�Ǥu�~�o�H�Y�Y�V�a�C�¤����γ~�ܤ֥i�H�Φb�U�C�u�~�G
1.
�������l��
2.
��l�l�N�o��
3.
�q�l�u�~
4.
���ݪ����B�z�u�{
5.
�Q���ݳB�z�u�~
6.
�Ӭۤu�~
7.
�콦�u�~
8.
�X���ֺ��u�~
9.
�s�Ĥu�~
10.���~���Ƥu�~
11.�ͤƤu�~
12.�����u�~
13.�A�Ĥu�~
14.�����u�~
���l�洫��������ʦӱa���洫���l���h�հ����l�E�X���A��������i�f�ӫD�ä[�ʪ����ܡC�����l�洫��ץi�洫�����������l�A�����l�洫��ץi�洫�����������l�C�����l�洫��ץD�n�i�����j�ĩʩM�z�ĩʡA�̥洫���l�����P�i�����B���M�u���F�����l�洫��ץD�n�i�����j�P�ʤήz�P�ʡA�̥洫���l�����P�i�����B��M�⫬�C�B�b��洫��O�ӺɮɡA�i���O�H�Q�ġB�һĶu�βB��ƶu���H�A�� (Regeneration)�A������p�U�G
����U�ث��A�����l�洫��סA�椬�զX�ϥΡA�i�H�s�y�A�X��U�ئ�~���¤��A��d�Ҧp�U�ҥܡC
|
�� �q �] �� |
����p�M�y�X������ |
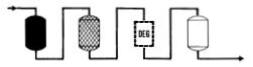 |
�ϥΦb������tSO4Cl�S�O�������p�U�A���G���z�P�����l�洫��ץ��ΨӰ��h�j�����������l�A�i�Υ�y���A�͡A�H�`�پާ@�O�ΡC�g���]�ƳB�z��A�y�X���������Q�]SiO2�^����0.02��0.15ppm�A��q��b10��20microhos�����C |
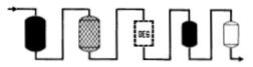 |
�ϥα��p�P�W�A�y�X������˹q��b3��5microhos�A�����Q�t�q�P�W�A���B����ե洫�����i�H��y���A�͡C |
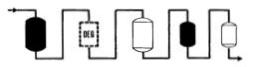 |
�ϥΦb�����P�ׯS�O�������p�A���Ӻ�s�Ϊ��洫�������g�`�A�͡A�B�z�᪺���˹q�ᬰ1��5microhos�����A�����Q�t�q�P�W�P�C |
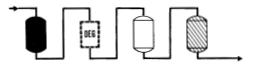 |
�ϥΦb�����u���l�S�O�������p�A�b�̫��s�Ϊ��洫�����θg�`�A�͡A���ܦ��Ī������u��|�C |
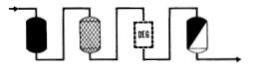 |
�Ω������㦳�ܰ���SO4�MCl�ɡA��z�P�����l�洫������ɦ����q�]�ƥi��ֲV�ɥ洫�����j�p�M�ާ@�O�ΡC |
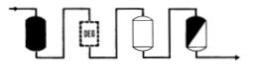 |
�p�G������㰪���P�שM�����Q�A�h�i�Φ��k�A�V�ɦ��洫���Χ@��s���ΡA�����g�`�A�͡C |
| �Ÿ������G | |||||
| �z�Ķ����l�洫���i�����MHCO3��OH���X��Ca�AMg��Na�C | �j�Ķ����l�洫���i�����Ҧ���Ca�AMg�MNa�A�B�洫��ͦ���H���l�A�i�MHCO3��CO3�@�ε��X��H2O��CO2�A�]�ӥi���h�P�סC | �V�ɦ��洫�� | |||
| �z�P�����l�洫���i����Cl��SO4 | �j�P�����l�洫�����i����Cl��SO4�~�A�|�i����SiO2��CO2 | ��һĶ�A�j��i���hCO2�A�u�Ŧ��i���hCO2��O2 | |||
| �U�����洫���B�z�᪺���� | |||||
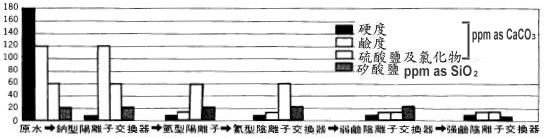 |
|||||
���B�W�¤����s�y
(Ultrapure Water)
�ҿW�¤��N�O�����«F��
99.99999%�A�䤤���l�t�q�� 0.01ppm
�H�U�C�@��¤��s�y���«��b 0.1ppm
�o�ؤ������M�w�g�ܯ¡A����\�h�u�~�p��l�l�N�o�Τ��B�b����B�u�źޡB�q���v���ޡB�����g�u�����s�y�u�~�A���«פ��������A�o�N�ݭn�ϥζW�¤��F�C�b�W�¤����s�y�W�O�N�¤��]�ƳB�z�᪺���A�g�L�A�;�ץ洫�A�A�H��K�L�o�����H�L�o�A�ñN���B�z�᪺���b�̫�B�z���B�J���`���B�z
(Loop)�A�H�o�W���«ת����C
�C�B�K�ο����ƦX��
�b�a�U�����g�`�i�o�{�o��طL�q���ƦX���A���̦��U�C�����I���`�A�]�����H�̩Ҥ��Ʊ�
(a)
�i���ż��A��´�~�C
(b)
�y���D�Ǥ��ޤ����Ψ�L�˸m���H���C
(c)
�W�[���ު��G�סC
�q�������h���̥i�����l�洫����k�A�ϥ��̦������H�������l���A�A���o�ذ��h����k�A������Y�ǭ���A�o�ث�˰��D�����K�ο�����k�A�Ϋ�˰����Q����ܡA�b�M�����峹���y���t���Q�סC
�K�B�����h�q
�����T���̪��Τ��A�^�H�Ʊ�q��ҥΪ��������h�Ҧ����ѩ�������t���l����A�Ϊ̦b�s�y�q�l�����ɡA��Ӫ��q��ާ@�A�ī~���s�y�Ψ�L�U�إγ~�A�ڭ̤]�Ʊ�q�������h�Ҧ��w���Ѫ��t���l����C
�t�~�b�Y�DZ��p�U�A�]�\�����t���L�q���v�ĤƦX���A���p�ڭ̥γo�˪����ӷdz���������A�N������`�A�]���������H�L�q���v�Ĥƪ���A�N�e���w�ܩʦ��J�զ�g�F�A�B�|�F�ԧ�C
�b���l�洫�b����k�|���o�i���e�A�ߤ@���h���������l�A�u���Ω��Q���]�H�k�Ӥw�A�����l�洫�k���b���A�������q����i�Q���h��@�Ӭ۷����{�צӥB��C���{�ץi�H�M�]�H�����@�Ӥ���A�Ϊ̦b�Y�ӨϥΪ��ت��W�A��]�H������n���ʽ�C
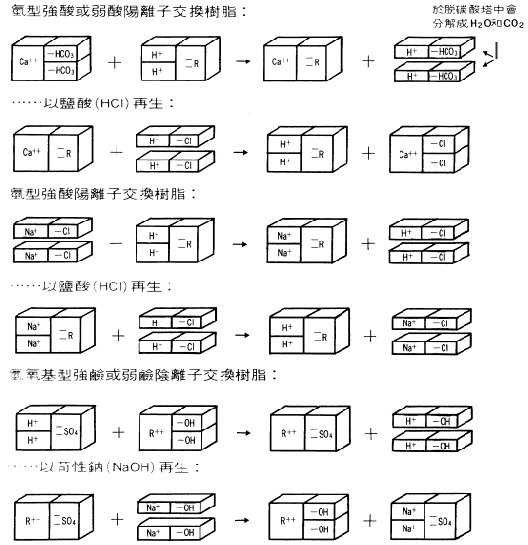
���l�洫�b���i������ӨB�J�G
�Ĥ@�B�J���ζ����l�洫��שM�IJ����٭�@�ΡA�@�ϥΪ��������l�Q�B���l�Ҩ��N�A���ǥH���h�������l�C
�ĤG�B�J���Ҳ��ͥX�Ӫ��ġA�i�Τw���P(�p�B��ƶu�B�κһĶu�BĬ����)���٭쪺�����l�洫��ץ[�H���h�C
�E�B��س����l���洫��
�����l�洫��צ��z�P�ʤαj�P�ʨ�ءG
�z�P�ʳ����l�洫���i�l���j�ġA�Ҧp�Q�ġB���ġB�v�ĵ��A���L�k���h�z�ġA�Ҧp�A�һ�(�G��ƺ�)���ĵ��z�ġA�o�إ洫���i�H��Ĭ����
(Soda ash Na2SO3)�B�������� (Ammonia)�B�e�ʶu
(Caustic Soda)
�A�͡A���i�H�洫�Ҧ������l���ױj�ĩήz�ġA�p�һ� (�G��ƺ�)�B����
(ֺ��)�B�Q�ġB���Ĥεv�ĵ��C
�Q�B�h�B�J�h�q����k
�p�e�ҭz�A���L�{���Ĥ@�B�A�O�]�B���l���N�Ҧ��������l�C�o�쪺�O��Ӥ����ҷ��ѷ��Q���������ġA�Ω�o�@�ӨB�J���ľ����j�ĩʡA�O�@�ز��D��
(Solutomic Acid) �����p�U�C��{���Ҧ��G
R.C.H
+ NaCl �� R.CNa + Cl
�B���l�洫���
+ ���������Q �� �u���l�����פW + �������Q
2RC.H
+ Ca(HCO3)2 �� (RC)2Ca + 2H2O
+ 2CO2
�B���l�洫���
+ �������һIJB�t �� �t���l�����פW+ �� +
�������G��ƺ�
RaOH
+ HCl �� RaCl + H2O
�B������l�洫���
+ �������Q�� �� �����l�����פW + ��
�ѩ�������һIJB�Q
(bicarbonate)
�κһ��Q�A�g�B���l�洫���ҩ�X���G��ƺ����M�i�H�Q�j�P�ʳ����l�洫���ҧl���A���b�\�h�ӷ~�˸m���F�g�٦X��_���A�ĥΥt�@�ذ��h��k�бN���p�Q����A���U�Q�L�˦��\�h���P��������A�åB�A�b�f�y�Ů�q�L��C
�Q�@�B�V�X�ɼѪk
�Y����g�L�W�z����ӨB�J�A���h�F�q����A�A�H���B�z�L�����y�g�L�ĤG��
(�]�i��ĤT�B�ĥ|��)�A�P�˪��˸m���h�q����]�ơA����C�@�ճƪ��y����A����e�@�զn�A�Q�Φ���h���ץi���A�N������Ъ��X���y�g�P�@�㦳�j�P�ʶ����l�A�αj�P�ʳ����l�洫��ת��ɼѡA�ұo���y�X����A�|�O���ת����t�q
�誺���A�b�����p�U�A�N�O���y�ϥΦP�ճ]�ƦӥN���˸m�\�\�h�h���s�B�ۦP�h�q����]�ơA�H���覡�B�z�L�����A�i�H�o���ª��y�X����A�������i�Ω�M�~
"Transistor (�q����)"�A�H�Ψ�L�q�l�˸m�Ω�з����O���T�礤�C
���M�G�ؾ�ײV�b�@�_�ϥΡA���ιL�F�n�A�ͪ��ɭԤ��i���Τ��O���}���G�h�A�Q�ΤG�ؾ�ױK�ײ��L���P�A�ΰf�y�Y�i�����G�h�A�A���O�A�͡A�}�M�H��A�A�Q�ΤW�y���Ů��w�[�H�A�V�X�A�K�i���s���ΡC
�Q�G�B�h�q��������ʽ�G
�αj�P�ʪ���βV�X�ɼѩұo���h�q������O�X�G"�����ħ�"�ҭq���Ǥ��зǡA���F�������P���˳Ʃү�ﵽ���S�I�A�ڭ̰��]���@�ح���ɹq��
450�L�کi�����A���Ѫ��T���Q������300ppm (�һĶt)
���R�p�U�G
�`�w�סG250ppm
�u�Q�G50ppm
�ɹq�סG450ppm
�P�סG200ppm
���β��ĮڡG100ppm
���ۡG16ppm
�g�L���P���B�z�L�{�A���G�p�U�G
�B�z�L�{ (�B�z�覡)
�ɹq��
����(ֺ��)
1.
�B���l�洫�� + �z�P�ʳ����l�洫
12 ~ 15
16
2.
�B���l�洫 + �z�P�ʳ����l�洫 + ����]��
7 ~ 8
16
3.
�B���l�洫 + �j�P�ʳ����l�洫
5 ~ 7
< 0.1
4.
�V�X�ɼ�
< 0.5
< 0.1
5.
�]�H��
2.5
�L
���G���Ѫ��T��U�h�A�h�ɹq�U�j�C
�Q�T�B�P�谣�h
�b���賡�Y�Ǧa�Ϫ�����A�t�������P��
(�Ҧp�t���h�q���һIJB�Q)�A���ɫ�u�O�n�h�P�� (�}�a�Ħ��һ��Q)
�Ӥ��Q�������h�q����A�h�U�C�G�k�i�Q�ΡG
1.
�����l�洫
�H�����l���N�������һIJB�����l
(HCO3-)
�A�Q�αj�P�ʳ����l�洫�����h��A���k�i�H���Q�@���٭쾯�A�o�O�@�ӫ�²�K����k�A�Ϊ��O���ާ@���G�����Q�@���٭쾯�A�]���|��֤����ҷ��Ѫ��T��h�֡G
RaCl
+ NaHCO3 �� RaHCO3 + NaCl
���
+ �b���� �� ��� + �b����
2.
�z�Ķ����l�洫
�z�Ķ����l�洫��סA�Y�g�L�F�Ī��������٭��A�B�i�H���N�z���Q���������l�A�p�һIJB�Q�A�����|���N�����Q���������l�A�Ҧp���Q�A�ҥH���i�H�Ψӭ�
pH �ȡA�p�U���G
R'CH
+ NaHCO3 �� R'CNa + H2O + CO2
���
+ �b���� �� ��� + �� + �b����
�Ҳ��ͪ��G��ƺҡA�i�ΰ���]�ư��h���C
�Q�|�B���l�洫����L����
���M���骺���l�洫�A���D�n���Ω�����B�z�A��������h�D�o�i�B�Ϋܼs�A�b�ӷ~�譱���i�Ω�}���ΰs����s�A���ĤΤƾ��ľ��������κ�s�A�o�����Q��
(�ۼo�����^���Ϊ���)
�b�M���u�~�譱�A�i�H�Ω����������A�Τp�ߪ������A�Ω���}�ܤ���i�o�����ݲV�X���A�B���}�ɷ��ݧx���B�·Ъ��V���C
�W�z�̫�γ~������Ҥl�A�N�O���Φb�}�g�ڤ��������}�A�Q�Ϊ��N�O�����������e�ܻ��Q
(Citrate) �s�Ĥu�~�W���Ҥl�A�N�O�i�Ω��������
(Streptomycin) ���X���L�R B12�C
�J���l�y�X������s�Φ۹q��G�����^�̤]���O�S�����Ϊ��Ҥl�A��פ]�Q��Ω����Ǫ����R�u�@�A�H����Ǫ��{�ɸ���C
�Q���B���l�洫�L�{���ާ@
�q�`���l�洫���i�H�s�����Ω�����B�z
(1)
�f�~��f�H�f�y�����X��������E���@�_���B�a����M���w
Channeling �i�H�@�����h�A�M���צA�w�m�n
(2)
�A�͡G�̤@�w���y�t�סA�ϦA�;����G�y�g��ק�
(3)
�M�~�G�L�h���A�;��Φ۾�שұo������A�i�H�b���L�{���h
(4)
�B�z����L�{�G(���ӹL�{)
�q�`������y��V�M�A�͡A�M�~�ɦP��V�A�����ɤ]�Q�ΰf�~��V�C
�@
�@
�@
�@
�@